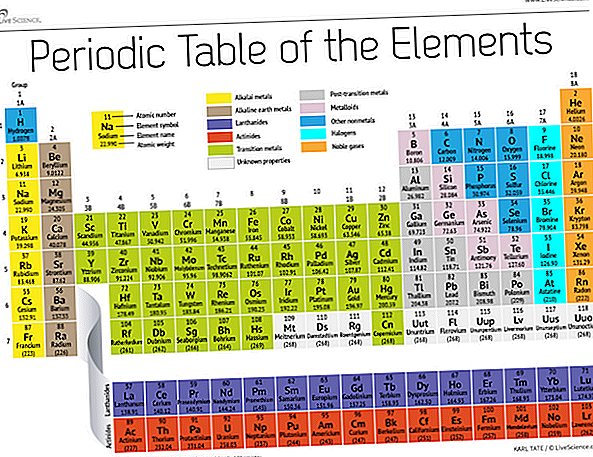
Vene keemik Dmitri Mendelejev avaldas 19. sajandi lõpus oma esimese katse keemiliste elementide rühmitamiseks nende aatommassi järgi. Omal ajal oli teada vaid umbes 60 elementi, kuid Mendelejev mõistis, et kui elemendid olid kaalu järgi järjestatud, tekkisid teatud tüüpi elemendid regulaarsete intervallide või perioodide kaupa.
Täna, 150 aastat hiljem, tunnustavad keemikud ametlikult 118 elementi (pärast nelja uue tulija lisandumist 2016. aastal) ja kasutavad nende korraldamiseks endiselt Mendelejevi perioodilist elementide tabelit. Tabel algab kõige lihtsama aatomi, vesiniku ja seejärel korraldab ülejäänud elemendid aatomnumbri järgi, milleks on prootonite arv, mida igaüks sisaldab. Mõne erandiga vastab elementide järjestus iga aatomi suurenevale massile.
Tabelis on seitse rida ja 18 veergu. Iga rida tähistab ühte perioodi; elemendi perioodinumber näitab, mitu selle energiatasemest sisaldab elektrone. Näiteks naatrium istub kolmandal perioodil, mis tähendab, et naatriumi aatomil on tavaliselt elektrone esimesel kolmel energiatasandil. Laua allapoole liikudes on perioodid pikemad, kuna suurema ja keerukama välimise taseme täitmiseks kulub rohkem elektrone.
Tabeli veerud tähistavad elementide rühmi või perekondi. Rühma elemendid näevad välja ja käituvad sageli sarnaselt, kuna nende välimises kestades on sama arv elektrone - nägu, mida nad maailmale näitavad. Näiteks rühma 18 elementidel, näiteks tabeli paremas servas, on täiesti täis väliskest ja nad osalevad keemilistes reaktsioonides harva.
Elemente klassifitseeritakse tavaliselt metallideks või mittemetallideks, kuid nendevaheline eraldusjoon on hägune. Metallielemendid on tavaliselt head elektri ja soojuse juhid. Metallide alarühmad põhinevad nende kollektsioonide sarnastel omadustel ja keemilistel omadustel. Meie perioodilise tabeli kirjelduses kasutatakse Los Alamose riikliku labori sõnul üldtunnustatud elementide rühmi.
Leelismetallid: Leelismetallid moodustavad suurema osa 1. rühmast ehk tabeli esimesest veerust. Need läikivad ja noaga lõigamiseks piisavalt pehmed metallid algavad liitiumiga (Li) ja lõppevad frantsiumiga (Fr). Need on ka äärmiselt reageerivad ja plahvatavad kokkupuutel veega leegi või plahvatavad, nii et keemikud ladustavad neid õlides või inertsetes gaasides. Vesinik koos oma ühe elektroniga elab samuti 1. rühmas, kuid gaasi peetakse mittemetalliks.
Leelismuldmetallid: Leelismuldmetallide metallid moodustavad perioodilise tabeli 2. rühma berülliumist (Be) kuni raadiumini (Ra). Igal neist elementidest on äärepoolseimas energiatasandis kaks elektroni, mis muudab leelismuldmetallid piisavalt reaktiivseteks, et neid võib looduses üksi leida. Kuid nad pole nii reaktiivsed kui leelismetallid. Nende keemilised reaktsioonid toimuvad tavaliselt aeglasemalt ja tekitavad leelismetallidega võrreldes vähem soojust.
Lantaniidid: Kolmas rühm on liiga pikk, et mahtuda kolmandasse veergu, nii et see murratakse välja ja libistatakse küljele, et saada saare ülemiseks reaks, mis hõljub laua allosas. See on lantaaniidid, elemendid 57 kuni 71 - lantaan (La) kuni luteetsium (Lu). Selle rühma elemendid on hõbedase valge värviga ja õhu käes kokkupuutel tuhmuvad.
Aktiniidid: Aktiniidid joondavad saare alumist rida ja sisaldavad elemente 89, aktiiniumi (Ac), läbi 103, seadusrentsiumi (Lr). Nendest elementidest leidub Maal looduses märkimisväärses koguses ainult tooriumi (Th) ja uraani (U). Kõik on radioaktiivsed. Aktiniidid ja lantaniidid moodustavad koos rühma, mida nimetatakse sisemisteks siirdemetallideks.
Siirdemetallid: Tulles tagasi tabeli põhiosa, esindavad ülejäänud rühmad 3 kuni 12 ülejäänud siirdemetalle. Kõvad, kuid vormitavad, läikivad ja hea juhtivusega on need elemendid, mida tavaliselt mõtlete, kui kuulete sõna metal. Siin elavad paljud metallimaailma suurimad hitid - sealhulgas kuld, hõbe, raud ja plaatina.
Üleminekujärgsed metallid: Enne mittemetallimaailma hüppamist pole jagatud omadused jaotatud korralikult vertikaalsete rühmaliinide järgi. Üleminekujärgseteks metallideks on alumiinium (Al), gallium (Ga), indium (In), tallium (Tl), tina (Sn), plii (Pb) ja vismut (Bi) ning need hõlmavad rühma 13 kuni rühma 17. Nendel elementidel on mõned üleminekmetallide klassikalised omadused, kuid need kipuvad olema pehmemad ja juhtivusega halvemini kui muud siirdemetallid. Mitmetes perioodilisustabelites on diagonaalis astatiini ühendava diagonaali all näidatud rasvases kirjas trepp. Üleminekujärgsed metallid koonduvad selle rea vasakpoolsesse vasakusse serva.
Metalloidid: Metalloidideks on boor (B), räni (Si), germaanium (Ge), arseen (As), antimon (Sb), telluur (Te) ja poloonium (Po). Need moodustavad trepi, mis tähistab järkjärgulist üleminekut metallidest mittemetallideks. Need elemendid käituvad vahel pigem pooljuhtidena (B, Si, Ge) kui juhtidena. Metalloide nimetatakse ka "poolmetallideks" või "vaesteks metallideks".
Mittemetallid: Kõik muu, mis asub trepi paremas ülanurgas - pluss vesinik (H), luhtunud tee tagasi rühmas 1 -, on mittemetall. Nende hulka kuuluvad süsinik (C), lämmastik (N), fosfor (P), hapnik (O), väävel (S) ja seleen (Se).
Halogeenid: Rühma 17 neli parimat elementi, alates fluorist (F) kuni astatiini (At), tähistavad mittemetalli kahte alamrühma. Halogeenid on üsna keemiliselt reageerivad ja kipuvad paarituma leelismetallidega, et saada erinevat tüüpi soola. Näiteks teie köögis olev lauasool on abielu leelismetalli naatriumi ja halogeenkloori vahel.
Väärisgaasid: Värvitu, lõhnatu ja peaaegu täielikult mittereaktiivsed inertsed või ülbed gaasid ümardavad rühma 18 tabeli. Paljud keemikud loodavad, et oganesson, üks neljast äsja nimetatud elemendist, jagab neid omadusi; kuna selle elemendi poolestusaeg on mõõdetud millisekundites, pole keegi seda otseselt testida saanud. Oganesson lõpetab perioodilise tabeli seitsmenda perioodi, nii et kui kellelgi õnnestub elementi 119 sünteesida (ja võistlus seda teha on juba käimas), ringleb ta ümber, et alustada leelismetallide kolonnis kaheksandat rida.
Tsüklilisuse tõttu, mis on loodud perioodilisuse kaudu, mis annab tabeli nime, eelistavad mõned keemikud Mendelejevi tabelit visuaalselt ringina kujutada.
Lisaks ressursse: