Aegade algusest peale on inimesed püüdnud mõista, millest koosneb universum ja kõik see. Ja kuigi muistsed magilased ja filosoofid kujutasid endast maailma, mis koosneb neljast või viiest elemendist - maa, õhk, vesi, tuli (ja metall või teadvus) -, hakkasid klassikalised antiikajad filosoofid teoretiseerima, et kogu mateeria koosneb tegelikult pisikesest, nähtamatud ja jagamatud aatomid.
Sellest ajast peale on teadlased tegelenud aatomiga pideva avastamise protsessiga, lootes avastada selle tegeliku olemuse ja meigi. 20. sajandiks muutus meie arusaam nii kaugele, et suutsime selle täpse mudeli konstrueerida. Ja viimase kümnendi jooksul on meie arusaam veelgi kaugemale jõudnud, kuni oleme jõudnud kinnitada peaaegu kõigi selle teoreetiliste osade olemasolu.
Tänapäeval on aatomiuuringud keskendunud mateeria struktuuri ja funktsiooni uurimisele alaatomilisel tasemel. See ei tähenda mitte ainult kõigi subatomiliste osakeste, mis arvatakse moodustavat aatomi, tuvastamist, vaid ka neid juhtivate jõudude uurimist. Nende hulka kuuluvad tugevad tuumajõud, nõrgad tuumajõud, elektromagnetism ja gravitatsioon. Siin on jaotus kõigest, mis me oleme seni aatomi kohta õppima jõudnud ...
Aatomi struktuur:
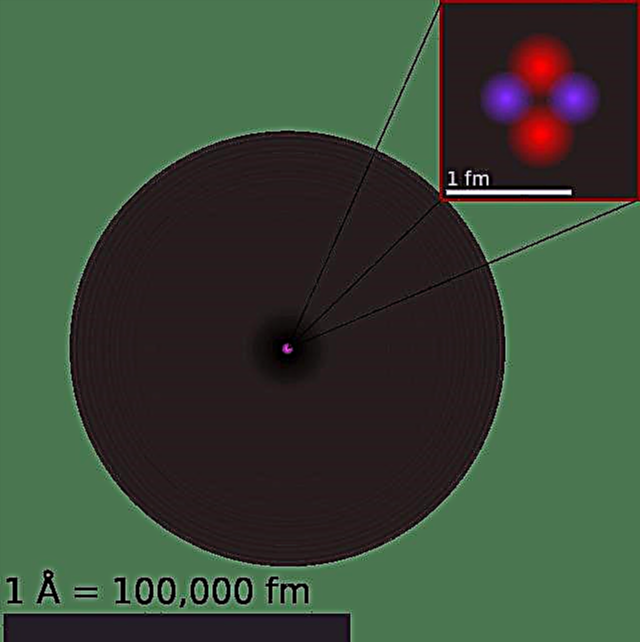
Meie praegune aatomi mudel saab jagada kolmeks komponendiks - prootoniteks, neutroniteks ja elektroniteks. Igal neist osadest on seotud laeng, kusjuures prootonid kannavad positiivset laengu, elektronid on negatiivse laenguga ja neutronid puuduvad netotasuga. Vastavalt osakeste füüsika standardmudelile moodustavad prootonid ja neutronid aatomi tuuma, elektronid aga tiirlevad selle ümber pilves.

Aatomis olevad elektronid tõmbavad tuumas olevaid prootoneid elektromagnetilise jõu abil. Elektronid pääsevad oma orbiidilt, kuid ainult vastusena välise energiaallika rakendamisel. Mida lähemal on tuumale elektroni orbiit, seda suurem on atraktiivne jõud; seega, seda tugevam on väline jõud, mis on vajalik elektroni põgenemiseks.
Elektronid tiirlevad tuuma mitme orbiidi ulatuses, millest igaüks vastab elektroni konkreetsele energiatasemele. Elektron saab muuta oma olekut kõrgemale energiatasemele, neelates footonit, millel on piisavalt energiat, et turgutada seda uude kvant olekusse. Samuti võib kõrgema energiaga olekus elektron langeda madalamasse olekusse, kiirgades liigset energiat footonina.
Aatomid on elektriliselt neutraalsed, kui nende prootonite ja elektronide arv on võrdne. Aatomeid, millel on kas defitsiit või elektronide ülejääk, nimetatakse ioonideks. Tuumast kõige kaugemal olevad elektronid võivad üle minna teistele lähedalasuvatele aatomitele või jagada aatomite vahel. Selle mehhanismi abil suudavad aatomid siduda molekulideks ja muud tüüpi keemilisteks ühenditeks.
Kõik need kolm subatomaatilist osakest on fermioonid - osakeste klass, mis on seotud mateeriaga ja mis on kas elementaarsed (elektronid) või komposiit (prootonid ja neutronid). See tähendab, et elektronidel puudub teadaolev sisestruktuur, samas kui prootonid ja neutronid koosnevad teistest subatomaatilistest osakestest. mida kutsutakse kvarkideks. Aatomites on kahte tüüpi kvarke, millel on murdosa elektrilaeng.

Prootonid koosnevad kahest “üles” kvarkist (kummagi laenguga +2/3) ja ühest “alla” kvarkist (-1/3), samas kui neutronid koosnevad ühest üles kvarkist ja kahest allapoole kvarki. See eristamine kajastab kahe osakese laengu erinevust, mis toimib vastavalt laenguna +1 ja 0, samas kui elektronide laeng on -1.
Muud subatomaatilised osakesed hõlmavad leptoneid, mis koos Fermionidega moodustavad aine ehitusplokid. Käesolevas aatomimudelis on kuus leptonit: elektronide, müonide ja tau osakesi ning nendega seotud neutriinoid. Leptoni osakeste erinevad sordid, mida tavaliselt nimetatakse maitseaineteks, eristuvad nende suuruse ja laengute järgi, mis mõjutab nende elektromagnetilise koostoime taset.
Siis on veel gabariidibossoone, mida nimetatakse "jõu kandjateks", kuna nad vahendavad füüsilisi jõude. Näiteks vastutavad gluoonid tugeva tuumajõu eest, mis hoiab kvarke koos, samas kui W ja Z bosonid (endiselt hüpoteetilised) vastutavad elektromagnetismi põhjustava nõrga tuumajõu eest. Footonid on elementaarosakesed, mis moodustavad valguse, samas kui Higgsi boson vastutab W- ja Z-bosonide masside andmise eest.
Aatommass:
Suurem osa aatomite massist pärineb tuuma moodustavatest prootonitest ja neutronitest. Elektronid on aatomi koostisosadest kõige vähem massiivsed, massiga 9,11 x 10-31 kg ja suurus on praeguse tehnikaga mõõtmiseks liiga väike. Prootonite mass on 1,826-kordsel elektronil 1,826-kordne, massil 1,6726 × 10-27 kg, samas kui neutronid on kolmest massilisemad, 1,6929 × 10-27 kg (1,839 korda elektroni massist).

Prootonite ja neutronite koguarvu aatomite tuumas (nn nukleonid) nimetatakse massiarvuks. Näiteks element Carbon-12 on nn, kuna selle massiarv on 12 - tuletatud selle 12 nukleonist (kuus prootonit ja kuus neutronit). Kuid elemendid on paigutatud ka nende aatomnumbrite põhjal, mis on sama kui tuumas leiduvate prootonite arv. Sel juhul on süsiniku aatomnumber 6.
Puhkeseisundis oleva aatomi tegelikku massi on väga raske mõõta, kuna isegi kõige massiivsemad aatomid on tavalistes ühikutes väljendamiseks liiga kerged. Sellisena kasutavad teadlased sageli ühtset aatommassiühikut (u) - nimetatakse ka daltoniks (Da) -, mida määratletakse kaheteistkümnendikuna süsiniku-12 vaba neutraalse aatomi massist, mis on ligikaudu 1,66 × 10-27 kg.
Keemikud kasutavad ka mooli - ühikut, mis on määratletud kui ühe mooli mis tahes elementi, millel on alati sama arv aatomeid (umbes 6,022 × 1023). See arv valiti nii, et kui elemendi aatommass on 1 u, on selle elemendi aatomite mooli massilähedane gramm. Ühtse aatommassiühiku määratluse tõttu on iga süsiniku-12 aatomi aatommass täpselt 12 u ja seega kaalub ühe süsiniku-12 aatomi mool täpselt 0,012 kg.
Radioaktiivne lagunemine:
Kõik kaks aatomit, millel on sama arv prootoneid, kuuluvad samasse keemilisse elementi. Kuid võrdse arvu prootonitega aatomitel võib olla erinev arv neutroneid, mis on määratletud kui sama elemendi erinevad isotoobid. Need isotoobid on sageli ebastabiilsed ja kõik need, mille aatomnumber on suurem kui 82, on teadaolevalt radioaktiivsed.
Kui element laguneb, kaotab selle tuum energiat kiirguse eraldamise teel - see võib koosneda alfaosakestest (heeliumi aatomitest), beetaosakestest (positronid), gammakiirtest (kõrgsagedusliku elektromagnetilise energiaga) ja muunduselektronitest. Ebastabiilse elemendi lagunemise kiirust nimetatakse selle “poolestusajaks”, mis on aeg, mis kulub elemendi langemiseks poole oma algväärtusest.
Isotoobi stabiilsust mõjutab prootonite ja neutronite suhe. 339 erinevat tüüpi elemendist, mis esinevad looduslikult Maal, on 254 (umbes 75%) märgistatud stabiilsete isotoopidena - st pole lagunemise all. Veel 34 radioaktiivse elemendi poolestusaeg on pikem kui 80 miljonit aastat ja need on olemas olnud ka varasest Päikesesüsteemist (seetõttu nimetatakse neid “ürgseteks elementideks”).
Lõpuks on teada, et lisaks 51 lühikese elueaga elemendile esinevad looduslikult muud elemendid (nt tuuma kõrvalsaadused) muude elementide (näiteks uraani raadiumi) lagunemisel. Lisaks võivad lühiajalised radioaktiivsed elemendid olla Maal toimuvate looduslike energeetiliste protsesside, näiteks kosmilise kiirguspommi tagajärg (näiteks süsinik-14, mis leiab aset meie atmosfääris).
Õppe ajalugu:
Varasemad teadaolevad aatomiteooria näited pärinevad Vana-Kreekast ja Indiast, kus sellised filosoofid nagu Democritus postuleerisid, et kogu mateeria koosneb pisikestest, jagamatutest ja hävimatutest ühikutest. Mõiste “aatom” loodi antiikses Kreekas ja see ajendas “atomismi” tuntud mõttekooli. See teooria oli siiski pigem filosoofiline kui teaduslik kontseptsioon.
Alles 19. sajandil muudeti aatomite teooria teaduslikuks küsimuseks, viies läbi esimesed tõenduspõhised katsed. Näiteks 1800-ndate alguses kasutas inglise teadlane John Dalton aatomi mõistet, et selgitada, miks keemilised elemendid reageerisid teatud jälgitavatel ja etteaimatavatel viisidel.
Dalton alustas küsimusega, miks elemendid reageerisid väikeste täisarvude suhtega, ja jõudis järeldusele, et need reaktsioonid toimusid diskreetsete ühikute täisarvudes, teisisõnu, aatomites. Gaasidega seotud katsete seeria käigus arendas Dalton välja nn Daltoni aatomiteooria, mis on tänapäevase füüsika ja keemia üks nurgakive.
Teooria taandub viiele ruumile: kõige puhtamas olekus elemendid koosnevad osakestest, mida nimetatakse aatomiteks; konkreetse elemendi aatomid on kõik samad, kuni viimase aatomini; Erinevate elementide aatomeid saab eristada aatommassi järgi; elementide aatomid ühinevad keemiliste ühendite moodustamiseks; aatomeid ei saa keemilises reaktsioonis luua ega hävitada, ainult rühmitus muutub kunagi.
19. sajandi lõpuks hakkasid teadlased teoretiseerima, et aatom koosneb rohkem kui ühest põhiosast. Enamik teadlasi julges aga arvata, et see ühik on väikseima teadaoleva aatomi - vesiniku - suurus. Ja siis 1897. aastal katoodkiirte abil katsete seeria kaudu füüsik J.J. Thompson teatas, et on avastanud üksuse, mis on vesinikuaatomist 1000 korda väiksem ja 1800 korda kergem.

Tema katsed näitasid ka, et need olid identsed osakestega, mida eraldasid fotoelektriline efekt ja radioaktiivsed materjalid. Hilisemad katsed näitasid, et see osake kandis elektrivoolu läbi metalltraatide ja negatiivseid elektrilaenguid aatomites. Seetõttu muudeti osake - mida algselt nimetati “korpuseks” - hiljem “elektroniks” pärast seda, kui osake George Georgestone Stoney ennustas 1874. aastal.
Siiski postuleeris Thomson ka seda, et elektronid olid jaotunud kogu aatomis, mis oli ühtlane positiivse laenguga meri. See sai tuntuks ploomipudingumudelina, mis hiljem osutub valeks. See leidis aset 1909. aastal, kui füüsikud Hans Gieger ja Ernest Marsden (Ernest Rutherfodi juhtimisel) viisid läbi oma katse, kasutades metallfooliumi ja alfaosakesi.
Kooskõlas Daltoni aatomimudeliga uskusid nad, et alfaosakesed läbivad väikese läbimõõduga fooliumi otse läbi. Kuid paljud osakesed kaldusid nurga alla 90 °. Selle selgitamiseks tegi Rutherford ettepaneku, et aatomi positiivne laeng koonduks keset pisikest tuuma.
1913. aastal pakkus füüsik Niels Bohr välja mudeli, kus elektronid tiirlesid tuumas, kuid suutsid seda teha ainult piiratud hulgal orbiitidel. Samuti tegi ta ettepaneku, et elektronid võiksid hüpata orbiitide vahel, kuid ainult diskreetsetes energiamuutustes, mis vastavad footoni neeldumisele või kiirgusele. See mitte ainult rafineeris Rutherfordi väljapakutud mudelit, vaid andis aluse ka kvantiseeritud aatomi kontseptsiooniks, kus mateeria käitus diskreetsetes pakkides.

Massispektromeetri arendamine - mis kasutab magnetiga ioonkiire trajektoori painutamiseks - võimaldas aatomite massi mõõta suurema täpsusega. Keemik Francis William Aston kasutas seda instrumenti, et näidata, et isotoopide massid olid erinevad. Sellele järgnes omakorda füüsik James Chadwick, kes pakkus 1932. aastal neutronit isotoopide olemasolu selgitamise viisina.
20. sajandi alguses arendati aatomite kvantlikku olemust edasi. 1922. aastal viisid Saksa füüsikud Otto Stern ja Walther Gerlach läbi eksperimendi, kus hõbeda aatomite kiir suunati läbi magnetvälja, mille eesmärk oli jagada kiir aatomite nurkkiiruse (või spinni) suuna vahel.
Stern-Gerlachi eksperimendina tuntud tulemuseks oli, et valgusvihk jagunes kaheks osaks sõltuvalt sellest, kas aatomite spinn oli suunatud üles või alla. 1926. aastal kasutas füüsik Erwin Schrodinger lainetena käituvate osakeste ideed matemaatilise mudeli väljatöötamiseks, mis kirjeldas elektrone kui kolmemõõtmelisi lainekujusid, mitte pelgalt osakesi.
Osakeste kirjeldamiseks lainekujude kasutamise tagajärjel on matemaatiliselt võimatu saada täpseid väärtusi nii osakese asukoha kui ka impulsi kohta igal ajahetkel. Samal aastal sõnastas Werner Heisenberg selle probleemi ja nimetas seda ebakindluse põhimõtteks. Heisenbergi sõnul saab antud täpse asukoha mõõtmise korral saada ainult impulsi tõenäoliste väärtuste vahemiku ja vastupidi.

Füüsikud avastasid 1930ndatel tuuma lõhustumise tänu Otto Hahni, Lise Meitneri ja Otto Frischi katsetele. Hahni katsed hõlmasid neutronite suunamist uraani aatomitele, lootes luua transuraani elementi. Selle asemel muutis protsess tema uraan-92 proovi (Ur92) kaheks uueks elemendiks - baarium (B56) ja krüptoon (Kr27).
Meitner ja Frisch kontrollisid katset ja omistasid selle uraani aatomite lõhestamiseks, moodustades sama aatomi kogukaaluga kaks elementi - protsess, mis eraldas ka aatomisidemete purustamisel arvestatava hulga energiat. Järgnevatel aastatel alustati selle protsessi võimaliku relvastamise (s.t tuumarelvade) uurimist ja see viis 1945. aastaks USA-s esimeste aatomipommide ehitamiseni.
1950ndatel võimaldas täiustatud osakeste kiirendite ja osakeste detektorite väljatöötamine teadlastel uurida kõrge energiaga liikuvate aatomite mõju. Sellest töötati välja osakeste füüsika standardmudel, mis on seni edukalt selgitanud tuuma omadusi, teoreeritud subatomaatiliste osakeste olemasolu ja nende koostoimimist reguleerivaid jõude.
Kaasaegsed katsed:
Alates 20. sajandi teisest poolest on aatomiteooria ja kvantmehaanika osas olnud palju uusi ja põnevaid avastusi. Näiteks 2012. aastal viis Higgs Bosoni pikk otsimine läbimurdeni, kus Šveitsi Euroopa Tuumauuringute Organisatsioonis (CERN) töötavad teadlased teatasid oma avastusest.

Viimastel aastakümnetel on füüsikud pühendanud palju aega ja energiat ühtse väljateooria (aka. Grand Unifying Theory või Theory of Everything) väljatöötamisele. Sisuliselt on standardmudeli esmakordsest väljapakkumisest alates teadlased püüdnud mõista, kuidas universumi neli põhijõudu (gravitatsioon, tugevad ja nõrgad tuumajõud ning elektromagnetism) toimivad.
Kui gravitatsiooni saab mõista Einsteini relatiivsusteooriate abil ning tuumajõude ja elektromagnetilisust saab mõista kvantteooria abil, siis kumbki teooria ei hõlma kõiki nelja koos töötavat jõudu. Katsed seda lahendada on aastate jooksul viinud paljude välja pakutud teooriateni, alates keelte teooriast kuni silmuskvantgravitatsioonini. Praeguseks pole ükski neist teooriatest läbimurret viinud.
Meie arusaam aatomist on jõudnud kaugele, alates klassikalistest mudelitest, mis nägid seda inertse tahke ainena, mis interakteerus teiste aatomitega mehaaniliselt, kuni kaasaegsete teooriateni, kus aatomid koosnevad energeetilistest osakestest, mis käituvad ettearvamatult. Ehkki selleks on kulunud mitu tuhat aastat, on meie teadmised kogu aine põhistruktuurist märkimisväärselt edasi arenenud.
Ja ikkagi on veel palju saladusi, mis on veel lahendamata. Aja jooksul ja jätkuvate jõupingutuste abil võime lõpuks lahti saada aatomi viimased allesjäänud saladused. Veelkord, võib väga hästi olla, et kõik meie tehtud uued avastused tekitavad ainult rohkem küsimusi - ja need võivad olla veelgi segasemad kui need, mis enne tuli!
Oleme ajakirjale Space Magazine kirjutanud palju artikleid aatomi kohta. Siin on artikkel John Daltoni aatomimudelist, Neils Bohri aatomimudelist, kes oli Democritus? Ja kui palju aatomeid on universumis?
Kui soovite lisateavet aatomi kohta, lugege NASA artiklit pisikeste proovide analüüsimise kohta ja siin on link NASA aatomite, elementide ja isotoopide kohta käiva artikli juurde.
Samuti oleme salvestanud terve episoodi astronoomiaosast, mis rääkis Aatomist. Kuulake siin, episood 164: aatomi sees, episood 263: radioaktiivne lagunemine ja osa 394: standardmudel, bosonid.