Juba ammu on teada, et kõigil molekulidel on kaks võrdset ja vastassuunalist laengut, mida eraldab teatud vahemaa. Selliste polaarsete molekulide korral ei lange negatiivse laengu keskpunkt kokku positiivse laengu keskpunktiga. Polaarsuse ulatust sellistes kovalentsetes molekulides saab kirjeldada terminiga Dipoolmoment, mis on põhiliselt polaarsuse kovalentse sideme polaarsuse mõõt.
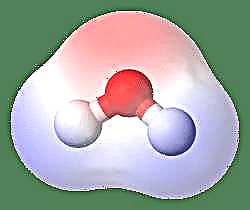
Dipooli lihtsaim näide on veemolekul. Veemolekul on polaarne selle elektronide ebavõrdse jaotuse tõttu "painutatud" struktuuris. Veemolekul moodustab nurga, mille tipus on vesinikuaatomeid ja tipus hapnik. Kuna hapnikul on suurem elektronegatiivsus kui vesinikul, on molekuli ja hapnikuaatomi küljel osaline negatiivne laeng, samas kui vesiniku keskel on osaline positiivne laeng. Seetõttu osutab dipoolmomendi suund hapniku poole.
Füüsika keeles on elektriline dipoolmoment positiivsete ja negatiivsete elektrilaengute eraldumise laengute süsteemis, see tähendab laengusüsteemi üldise polaarsuse mõõt - st molekulide elektrilaengu eraldamine, mis viib dipoolini. Matemaatiliselt ja kahe punktlaengu, ühega, millel on laeng + q, ja teise, millel on laeng? Q, lihtsa juhtumi korral saab elektrilise dipoolmomendi p väljendada järgmiselt: p = qd, kus d on negatiivse laengu ja positiivne laeng. Seega osutab elektrilise dipoolmomendi vektor negatiivsest laengust positiivsele laengule.
Teine võimalus selle vaatamiseks on dipoolmomendi tähistamine kreeka tähega m, m = ed, kus e on elektrilaeng ja d on eralduskaugus. Seda väljendatakse debüüsi ühikutes ja kirjutatakse D-ga (kus 1 debye = 1 x 10-18e.s.u cm). Dipoolmoment on vektori suurus ja seetõttu on seda tähistatud väikese noolega, mille saba on positiivses keskpunktis ja pea on suunatud negatiivse keskpunkti poole. Veemolekulide korral on dipoolmoment 1,85 D, vesinikkloriidhappe molekul on aga 1,03 D ja seda saab esitada järgmiselt:
Oleme ajakirjale Space Magazine kirjutanud palju artikleid dipoolmomendi kohta. Siin on artikkel sellest, millest vesi on tehtud, ja siin on artikkel molekulide kohta.
Kui soovite lisateavet dipoolmomendi kohta, vaadake neid artikleid Hyperphysics and Science Daily.
Samuti oleme salvestanud terve episoodi astronoomiast, milles räägitakse kõike kosmoses olevate molekulide kohta. Kuulake siin, episood 116: Molekulid kosmoses.
Allikad:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule